«Машина времени» для химика
Окончание. Начало в № 42
Четвертая встреча проекта «Научные weekend'ы» Иркутского государственного университета и клуба молодых ученых «Альянс» состоялась 16 октября. «Как часто химик смотрит на часы?» – ответ на этот вопрос слушателям представила Анна Курохтина, кандидат химических наук, доцент кафедры физической и коллоидной химии, старший научный сотрудник научно-исследовательского института нефте- и углехимического синтеза при ИГУ. Предлагаем вам вторую часть лекции.
Химию – в жизнь
В ХХ веке расцвели многие науки, и химики установили, что катализаторы существуют и в живой природе. В частности, в теле человека их огромное количество, а называть их стали ферментами. После этого открытия стало понятно, что изучение каталитических реакций имеет огромное значение не только для химического производства, но и с точки зрения управления живой природой.
Однако самые большие усилия химики направили на изучение процессов крупнотоннажного производства. Фриц Габер (1868–1934), известный как «отец химического оружия», разработал процесс производства аммиака из атмосферного азота. Решение этой проблемы означало, что наука снимает ограничение на рост населения планеты: атмосферный азот превращается в удобрения, которые восстанавливают плодородие почвы, и таким образом снимается проблема голода, от которого страдали все страны еще в начале ХХ века. С точки зрения химиков, проблема состояла в том, что молекула, состоящая из двух атомов азота, является очень устойчивой, и без применения каталитической химии решить ее не удавалось.
Габер в 1909 году показал, что при использовании порошкового осмия, нагреве до 600 градусов по Цельсию и при давлении 17,5 мегапаскалей (что в 175 раз больше нормального атмосферного давления) можно получать аммиак из атмосферного азота и водорода. Для превращения лабораторного процесса в производственный требовалось специфическое оборудование, которое для концерна BASF разработал химик Карл Бош (1874–1940). Первый завод для производства аммиака был открыт в 1913 году, а позднее вместо осмия была использована комбинация оксидов железа, калия, алюминия и кальция.
Производство аммиака в мире сегодня составляет сотни миллионов тонн, и, по словам Анны Курохтиной, не менее половины населения земли питается продуктами, полученными при помощи этих удобрений. За свои заслуги в разработке процесса производства аммиака Габер получил в 1918 году Нобелевскую премию по химии, но невозможно забыть, что именно Габер был автором и идейным вдохновителем применения химического оружия в ходе Первой мировой войны.
Важнейшие для мировой промышленности процессы производства серной кислоты идут сегодня с применением катализатора – оксида ванадия, а для процессов переработки нефти используются многочисленные катализаторы из редкоземельных элементов, полиметаллические, цеолитсодержащие и т. д. Продолжая изучение каталитических процессов и методов повышения их эффективности, химики установили, что катализатор не входит в состав конечного вещества, но в процессе реакции образует с реагирующими компонентами промежуточные вещества. А те, в свою очередь, превращаются в конечные продукты с большей скоростью, чем без катализатора.
Не менее важно, что катализатор избирательно ускоряет одно из многих возможных направлений реакции, то есть обладает селективностью. Из этилового спирта, к примеру, можно получить до 40 различных продуктов, а каталитический процесс позволяет выбрать один из них. Поэтому теперь определение катализа звучит так: избирательное ускорение одного из термодинамически возможных направлений реакции в присутствии веществ (катализаторов), многократно вступающих в промежуточное взаимодействие с субстратами, но восстанавливающих после каждого цикла промежуточных изменений свой химический состав.
– С точки зрения ускорения химических реакций и решения проблемы «ненужных» веществ катализ является оптимальным решением. Девяносто процентов химических процессов сегодня – это процессы каталитической химии, – подчеркнула Анна Курохтина. – Если говорить о причинах эффективности каталитических процессов, то нужно вспомнить о существовании энергетического барьера: образование промежуточных продуктов требует меньших затрат, преодоления меньшего порога. Чем ниже порог, тем большее количество молекул могут вступить в реакцию.
Премию – в лабораторию
Нобелевский комитет неоднократно отмечал значение изучения каталитических процессов своими решениями. В 1912 году Поль Сабатье (1854–1941) получил премию «за метод гидрогенизации органических соединений в присутствии мелкодисперсных металлов, который резко стимулировал развитие органической химии». За это же открытие Сабатье иногда называют «отцом маргарина», хотя его процессы используют и при производстве других продуктов – на разных стадиях и в больших количествах.
В 1963 году премию разделили Карл Циглер (1898–1973) и Джулио Натта (1903–1979) «за их открытия в области химии и технологии высокомолекулярных полимеров». Эти химики, в отличие от многих других, получивших премию на двоих, не сотрудничали, а конкурировали друг с другом. Циглер изобрел процесс получения полиэтилена из этилена, а Натта из пропилена сделал полипропилен. Степень распространения этих продуктов настолько очевидна, что ХХ век иногда называли «полиэтиленовым веком».
Премия 1972 года досталась Станфорду Муру (1913–1982) и Вильяму Стейну (1911–1980) «за их вклад в прояснение связи между химической структурой и каталитическим действием активного центра молекулы рибонуклеазы». Речь идет об изучении ферментов живого организма и их воздействии на различные процессы, выявлении влияния недостатка ферментов на здоровье и так далее.
«Нобель» 1973 года вручен Джеффри Уилкинсону (1921–1996) и Эрнсту Фишеру (1918–2007) «за новаторскую, проделанную независимо друг от друга работу в области химии металлоорганических, так называемых сэндвичевых, соединений» И хотя эта тема формально не связана с катализом. Но речь идет о создании соединений, в которых атом металла окружен как в настоящем сэндвиче, какими-то органическими молекулами. За развитие этой темы химик Генри Таубе (1915–2005) получил половину Нобелевской премии 1983 года «за изучение механизмов реакций с переносом электрона, особенно комплексов металлов». В совокупности работы этих трех химиков заложили фундамент современного высокоэффективного и высокоселективного катализа комплексами переходных металлов.
В 1975 году Джон Корнфорт получил Нобелевскую премию «за исследование стереохимии реакций ферментативного катализа». Многие вещества имеют одинаковый химический состав, но они формируют молекулы разной структуры, и такие изомеры имеют разные свойства. В теле человека многие ферменты отличаются друг от друга так же, как правая рука отличается от левой, то есть атомы в молекуле располагаются в «зеркальном отражении» (иными словами, являются хиральными изомерами). Многие процессы в организмах происходят с участием только одного из изомеров – белки, например, построены из левых аминокислот, а сахара – правые изомеры. Корнфорт сумел изучить и показать, как тот или иной фермент в зависимости от своей хиральной структуры необходим или бесполезен для организма.
За открытие каталитических свойств рибонуклеиновых кислот Томас Чек и Сидни Олтман получили Нобелевскую премию 1989 года. До их исследования считалось, что РНК только переносят наследственную информацию, теперь же стало понятно, что значение этих молекул еще больше. Спустя восемь лет Пол Бойер и Джон Уокер получили нобелевку «за выяснение ферментивного механизма, лежащего в основе синтеза аденозинтрифосфата (АТФ)». АТФ играет важнейшую роль во всех энергетических процессах в организме, поэтому переоценить значение работы Бойера и Уокера невозможно.
Нобелевскую премию 2001 года разделили Уильям Ноулз и Рёдзи Ноёри «за работы по реакциям гидрирования на хиральных катализаторах» и Барри Шарплесс «за работы по реакциям окисления на хиральных катализаторах». Как уже было сказано, человеческому организму ферменты нужны в виде конкретного, левого или правого, изомера. Однако при обычном производстве они получаются в равных количествах. С 1956 по 1962 год большой популярностью пользовался седативный препарат талидомид, который погружал пациентов в глубокий сон, но, как позднее выяснилось, вызывал многочисленные побочные эффекты, включая врожденные уродства у детей. Причиной уродств, как оказалось, был один из изомеров вещества, а второй просто подавлял тошноту и имел успокаивающее действие. Ноулз, Ноёри и Шарплесс как раз разработали процессы, которые позволяют сделать производство изомеров веществ высокоселективным.
В 2005 году Нобелевскую премию вручили Роберту Граббсу, Иву Шовену и Ричарду Шроку «за вклад в развитие метода метатезиса в органическом синтезе». Метатезис – это процесс, который позволяет молекулам участвующих в реакции веществ обмениваться отдельными фрагментами для получения необходимого экспериментатору результата. Реакции метатезиса сокращают количество промежуточных этапов, поэтому их считают «шагом к зеленому производству».
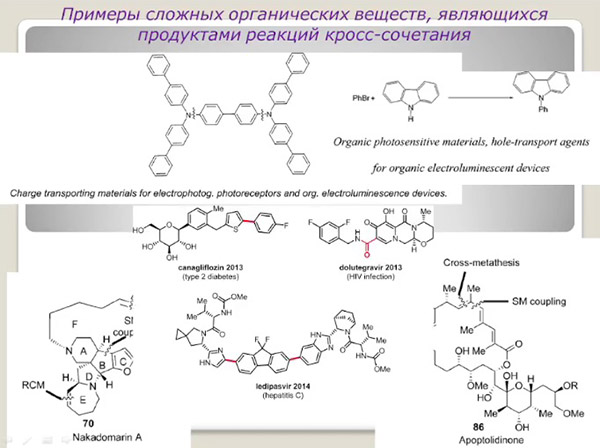
Премия 2010 года, врученная Ричарду Хеку, Ейичи Негиши и Акире Сузуки «за палладий-катализируемые реакции кросс-сочетания в органическом синтезе», считается продолжением той же экологической тематики. Кросс-сочетания позволяют взять две большие молекулы и соединить их избирательно и очень точно по конкретным участкам. При таком селективном и точном подходе сокращается количество отходов и увеличивается выход требуемого продукта, поэтому метод пользуется большой популярностью в фармакологии.
Исследования продолжаются
Чтобы выбрать идеальный катализатор из сотен тысяч имеющихся, ученым сегодня нужно очень точно знать, что происходит в реакциях. Механизм реакции в современном представлении – это совокупность простых реакций, из которых состоит сложная реакция. Сегодня химики понимают, что в процессах участвует не то вещество, которое они загружают в емкость, где происходит реакция, а некое предварительное вещество. В теории катализатор должен действовать вечно, но на практике со временем эффект побочных превращений приводит к снижению эффективности катализатора и прекращению реакции – или, как говорят специалисты, «отравлению катализатора».
Над этой проблемой работают – иногда катализатор можно повторно активировать. Квантовые химики пытаются разобраться в процессах при помощи расчетов: зная энергии исходных веществ и исследуя разные варианты процессов превращения, ищут наименее затратный из них. Эти исследования идут очень активно, но остается поле деятельности и для химиков-экспериментаторов. Чем больше и сложнее молекула, тем больше вариантов превращений, тем сложнее работа для квантовой химии, а любые теоретические результаты неизбежно нужно проверить на практике.
Из-за того, что катализатор является очень активным веществом, промежуточные соединения иногда существуют очень короткое время, и проблема состоит в том, чтобы уловить и исследовать их в эти мгновения. Но мало зафиксировать момент присутствия вещества в реакции, нужно установить его роль в процессе – и именно здесь нужно посмотреть на часы. Нужно понять, как ведет себя исследуемая частица во времени: как меняется количество веществ, что с ними происходит и в какой последовательности.
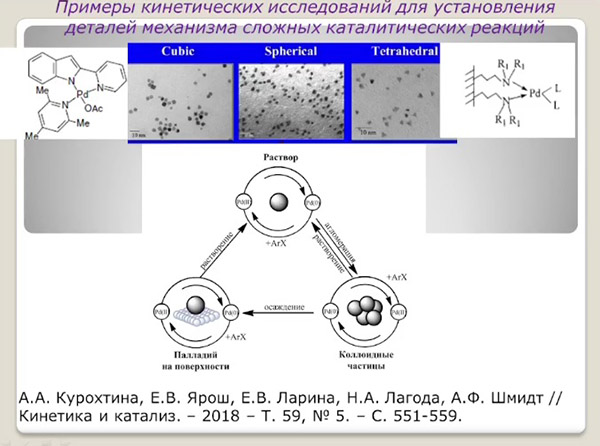
Если взять некий катализатор, существующий в виде раствора, коллоидных частиц и реагирующей поверхности, то перед химиками встает задача: какая из форм наиболее эффективна и долговечна? Существуют методы устранения одной из форм, но как оказалось, все они успешно и очень быстро переходят одна в другую и точную информацию таким способом получить нельзя. Химики Ричард Финке и Джейсон Вайдегрен установили, что после введения катализатора существует промежуток времени, во время которого катализатор присутствует, а процесс еще не идет. Это означает, что на реакцию влияет не сам известный нам катализатор, а то, во что он превращается с течением времени.
Группа голландских химиков обнаружила процессы «гомеопатического катализа» – то есть превращения веществ при снижении количества катализатора. По существу, это нарушение закона масс реагирующих веществ, предполагающего, что с увеличением концентрации реагирующих веществ скорость реакции должна увеличиваться. Это подтверждает предположение, что на скорость реакции влияет не только количество вещества, но и снижение скорости побочных процессов предварительного превращения катализатора в какое-то промежуточное вещество. Именно поэтому количество итогового продукта увеличивается при минимальном содержании катализатора.
Сегодня химики активно используют в работе давно известный метод «конкурирующих реакций»: в реакцию включают не один, а два похожих катализатора. Это позволяет исключить из уравнения скорости процесса концентрацию веществ – скорость будет зависеть только от известных ученым констант скоростей реакции, обусловленных самой природой реагирующих веществ. Далее, используя математический метод фазовых траекторий, химики могут установить, как в процессе меняется катализатор, и более точно понять природу происходящих с ним процессов.
– Для дальнейшего развития химии залог успеха – слаженная работа и химиков-экспериментаторов, и химиков-аналитиков, и химиков-расчетчиков. Рано или поздно мы во всех процессах разберемся, и это будет полезно и для науки, и для всего человечества, – сказала Анна Курохтина, подводя итог своего рассказа.

Записал Борис Самойлов, «Байкальские вести».
Иллюстрации из презентации Анны Курохтиной
Поделитесь новостью с друзьями:
Для добавления авторизуйтесь или зарегистрируйтесь.